Vaccini e Covid-19. Confusione e disinformazione
Articolo di Carla Rossi *
11 gennaio 2021 10:31
Si legge e si sente continuamente dire che: I vaccini non sono stati correttamente sperimentati ed è impossibile che in 8 mesi si sia riusciti a fare tutto quello che normalmente si fa in 8 e anche più anni.
La confusione, circa la velocità della sperimentazione dei vaccini relativi al Covid-19, rispetto alle velocità delle precedenti sperimentazioni, è dovuta alla non conoscenza delle regole scientifiche ed etiche, relative alle sperimentazioni, che non riguardano mai la durata degli esperimenti.
E' necessario fare chiarezza sul tema, avendo a lungo fatto parte di vari Comitati Etici per l'autorizzazione alle sperimentazioni cliniche per nuove terapie o vaccini.
Per gli aspetti scientifici riguardanti le sperimentazioni cliniche riporto lo schema (Figura 1), relativa alla sperimentazioni dei vaccini, che si trova sul sito dell'European Medicines Agency, EMA.
Figura 1. Schema generale completo relativo alle sperimentazioni di nuovi vaccini.
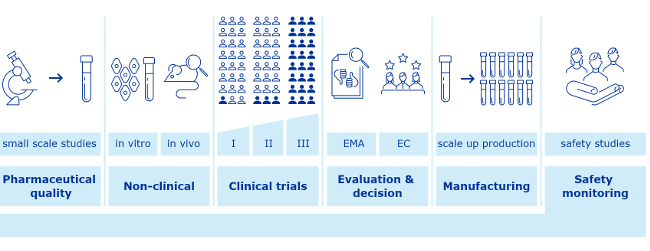 Come si nota, è prevista inizialmente una sperimentazione di laboratorio, non sempre necessaria se si utilizzano tipi di preparazione già noti dal punto di vista farmaceutico.
Come si nota, è prevista inizialmente una sperimentazione di laboratorio, non sempre necessaria se si utilizzano tipi di preparazione già noti dal punto di vista farmaceutico.Per fare un esempio, possiamo considerare una preparazione farmaceutica, utilizzata già per una data malattia, che si pensa possa essere utilizzata anche per altra malattia, come è successo proprio per le terapie tentate nel 2020 per il Covid-19; in questo caso non è necessaria nessuna sperimentazione di laboratorio relativa alla qualità farmaceutica.
Spesso si possono evitare le sperimentazioni in vitro e anche negli animali che, in molti casi, non sono obbligatori né utilizzabili. Non si possono, invece, mai evitare i "clinical trials" (studi clinici), che devono essere approvati anticipatamente da un Comitato Etico perché sono sperimentazioni su persone.
Nel caso delle sperimentazioni relative al vaccino Covid-19, non sono stati necessari esami di laboratorio.
Sono state autorizzate e condotte le sperimentazioni di fase I, II e III, relative ai "clinical trials", necessarie per l'autorizzazione all'utilizzo dei vaccini. La sintesi dei risultati si trova sul sito dell'EMA.
E' fondamentale spiegare perchè le procedure sono state così veloci rispetto a casi precedenti.
Le sperimentazioni in vivo di nuovi vaccini, o di nuove terapie, anche con medicine già note, ma usate per altre malattie, si fanno seguendo tre fasi sperimentali.
Prima fase.
La Prima fase si effettua per valutare se è il caso di procedere. La numerosità campionaria e il finanziamento sono limitati. La Prima fase ha esito medio positivo se:
- il vaccino innesca la risposta immunitaria prevista;
- il vaccino è sicuro per passare a studi più ampi.
Si procede con la Seconda fase, con numerosità campionaria maggiore, che ha come obiettivo risultati positivi non solo in media, ma con test affidabili per verificare che il vaccino inneschi una buona risposta immunitaria in una popolazione più ampia. Naturalmente, il finanziamento è maggiore della Prima fase.
Terza fase.
Per introdurre l'utilizzo standard del vaccino, nella popolazione generale, si deve eseguire la Terza fase, con numerosità ancora maggiore e con l'obiettivo di affidabilità del risultato, ovvero, si verifica se il vaccino è efficace nel proteggere dall'infezione rispetto al placebo (gruppo di controllo) o a un trattamento alternativo, e quali sono gli effetti collaterali meno comuni in chi riceve il vaccino. Naturalmente, il finanziamento necessario è ancora maggiore delle precedenti fasi.
Se è disponibile un consistente finanziamento, si può far coincidere la Seconda e la Terza fase e abbreviare il tempo di sperimentazione.
Come si vede la validità di una sperimentazione clinica non dipende dal tempo impiegato, ma dalla numerosità campionaria, che è sostenuta dal finanziamento disponibile. Quando il finanziamento è limitato, si procede più lentamente nell'arruolamento di soggetti da testare e la sperimentazione dura di più.
Questo è quanto è accaduto per le sperimentazioni relative ai vaccini contro il Covid-19, perché era notevole l'interesse e, di conseguenza, è stato consistente il finanziamento mondiale.
Il campione Pfizer, per esempio, già nella seconda fase, è stato molto numeroso, con decine di migliaia di soggetti, fornendo, quindi, risultati di Seconda-Terza fase contemporanei in un tempo limitato.
L'unico problema è la "safety monitoring", valido per tutti i farmaci e i vaccini.
Nel periodo di somministrazione, a distanza di tempo, potrebbero emergere possibili effetti collaterali che, però, non rientrano nella procedura relativa all'approvazione; tali effetti, nel caso si presentassero, sono resi noti attraverso il "safety monitoring", in costante aggiornamento presso l'Autorità sanitaria competente.
Spero che sia chiaro come si conducono le sperimentazioni cliniche che, prima di essere attuate, devono essere approvate da "Comitati Etici" nei quali è presente un esperto bio-statistico.
Per la validità di una sperimentazione clinica è fondamentale la numerosità campionaria dei soggetti e non del tempo di sperimentazione, come erroneamente è propugnato dai media e creduto dai cittadini.
* Presidente del Centro di Studi Statistici e Sociali (Ce3S), già Professore all'Università di Roma Tor Vergata. Esperta di modellizzazione ed analisi statistica con applicazioni in campo biomedico e sociale
l’associazione non percepisce ed è contraria ai finanziamenti pubblici (anche il 5 per mille)
La sua forza sono iscrizioni e contributi donati da chi la ritiene utile
DONA ORA
ARTICOLI IN EVIDENZA
18 aprile 2024 15:40
18 aprile 2024 0:33
17 aprile 2024 13:45
17 aprile 2024 11:55
17 aprile 2024 0:19
16 aprile 2024 15:18
15 aprile 2024 13:16
15 aprile 2024 11:26
15 aprile 2024 10:47
14 aprile 2024 18:48
TEMI CALDI
18 aprile 2024 (2 post)
16 aprile 2024 (1 post)
16 aprile 2024 (1 post)
10 aprile 2024 (1 post)
9 aprile 2024 (1 post)
4 aprile 2024 (1 post)
4 aprile 2024 (1 post)
2 aprile 2024 (1 post)
29 marzo 2024 (1 post)
15 marzo 2024 (1 post)






